INTRODUCCIÓN
La familia Enterobacteriaceae (Orden Enterobacterales) está formada por bacilos gramnegativos (BGN) que clínicamente adquieren gran importancia debido a que son causantes de las infecciones intrahospitalarias y de las infecciones que se adquieren en la comunidad, debido a que pueden llegar a causar infecciones en el tracto urinario, tracto respiratorio, torrente sanguíneo y en heridas expuestas (Lepe y Martínez-Martínez, 2022; Struthers, 2018; Chicaiza-Taypanta, 2021; Rojas et al., 2021; Sacsaquispe-Contreras y Bailón-Calderón, 2018).
Durante la pandemia del COVID-19, la OPS/OMS, emitió la alerta epidemiológica donde reportan que en Latinoamérica y el Caribe se ha producido un aumento de nuevas mezclas de carbapenemasas en enterobacterales, así mismo menciona que este incremento esta posiblemente relacionado al aumento en el uso descontrolado de antibióticos de amplio espectro en enfermos con COVID-19 (OPS/OMS, 2021).
En el Perú, Yañez (2021) reportó que la enfermedad COVID-19 provocó un aumento acelerado en el número de pacientes hospitalizados en las unidades de cuidados intensivos, a la vez, se evidenció el uso irracional de antimicrobianos sin sustento farmacológico, que trajo como consecuencia un incremento en la presencia de microorganismos resistentes a diferentes antimicrobianos (Vinicoff et al., 2022).
El incremento de la resistencia bacteriana se debe a la presencia de unas enzimas denominadas ß-lactamasas, las cuales inhiben el mecanismo de acción de los antibióticos ß-lactámicos mediante el proceso de hidrolisis del antibiótico (León-Luna et al., 2021; Chicaiza-Tayupanta y Chicaiza-Quishpe, 2021). Dentro de los ß-lactámicos, se pueden mencionar a los carbapenémicos, los cuales presentan un amplio espectro de actividad antibacteriana contra microorganismos grampositivos y gramnegativos (Rada et al., 2019), y debido a que son los más eficaces, estos son considerados dentro de los medicamentos en la última línea y más confiable de los fármacos para tratar las infecciones bacterianas, además de ser más seguros que otros fármacos similares pues presentan pocas consecuencias adversas en las personas (Worku et al., 2022).
Por ello, el presente estudio tuvo como objetivo determinar el tipo de carbapenemasa presente en las Enterobacterales, Pseudomonas aeruginosa y Acinetobacter spp. aisladas de los pacientes hospitalizados en la Unidad de Cuidados Intensivos del Hospital IV “Víctor Lazarte Echegaray”. Trujillo-Perú, durante la pandemia por COVID-19, 2020.
MATERIALES Y MÉTODOS
La población estuvo constituida por 129 cultivos obtenidos de los pacientes de UCI del Hospital IV “Víctor Lazarte Echegaray”, en los cuales se determinó la resistencia a imipenem o meropenem así como la carbapenemasa presente en cada cultivo. Las muestras biológicas de secreción bronquial, orina aséptica, sangre, catéter venoso central, secreción de herida y otros líquidos biológicos; se recolectaron y procesaron siguiendo los lineamientos del Manual de procedimientos de laboratorio: laboratorios locales I: laboratorios locales II del Ministerio de Salud /Instituto Nacional de Salud (Zurita Macalupú, 2013).
Se seleccionaron las colonias que presentaron crecimiento en las placas con agar Mac Conkey, las cuales posteriormente se identificaron a través del sistema automatizado MicroScan™ AutoScan-4 (Siemens Healthcare Diagnostics Inc. USA); La identificación y susceptibilidad antimicrobiana se realizó en los paneles para bacterias Gram negativas, teniendo en cuenta el panel Neg Entero Combo Panel Type 72 (Siemens Healthcare Diagnostics Inc, EE. UU.) que contiene los carbapenémicos imipenem, meropenem y ertapenen los cuales pueden usarse en el tratamiento de enterobacterias, Pseudomonas aeruginosa y Acinetobacter spp. presentes en muestras de orina y sistémicas; el procedimiento de identificación y susceptibilidad bacteriana incluye realizar una suspensión bacteriana para inocular 100 uL de la suspensión en los pocillos de los paneles, los cuales fueron incubados durante 16 a 18 horas a 35 °C, siguiendo las indicaciones del Manual de procedimiento para microorganismos gramnegativos. Todos los procedimientos se realizaron de acuerdo con las instrucciones del fabricante que incluye el sistema expert-Alert que utiliza el crecimiento en presencia de cefpodoxima (4 µg/mL) y ceftazidima (1 µg/mL), en las concentraciones recomendadas por The Clinical and Laboratory Standards Institute CLSI donde los resultados de MIC sirvieron como indicador principal o de alerta de estar frente a Extended spectrum β-lactamase (ESBL) (Zurita Macalupú, 2013; Ali Abdel Rahim y Ali Mohamed, 2014; Mayta-Barrios et al., 2021).
Para la identificación de las enzimas carbapenemasas que ocasionan la resistencia a los carbapenémicos se utilizó técnicas Inmunocromatográficas de diagnóstico rápido, en este método se evaluaron los cultivos que presentaron una CMI de 2ug/ml al menos para un carbapenémico Imipenem o Meropenem (March-Rosselló, 2017; Josa-Montero et al., 2021). En el presente estudio se utilizó el RESISIT-3 O.K.N K-SET “Test de diagnóstico rápido para la detección de carbapenemasas de OXA-48, KPC y NMD manufacturado por la empresa Coris BioConcept los cuales en estudios previos han demostrado una sensibilidad del 96% y especificidad de 100% para la detección de NDM, OXA-48 y KPC (Coris Bio Concept, 2023; Instituto de Salud Carlos III, 2023).
Los datos obtenidos se registraron en hojas de trabajo PID3 y NID2 propias de los paneles de trabajo y luego se transfirieron al software LabPro versión 4,43 para la determinación del “biotipo”; los resultados con probabilidades ≥85% se consideraron fiables, y los de probabilidad baja <85% se consideraron "no confirmados" (Ali Abdel Rahim y Ali Mohamed, 2014). En este estudio, no se realizaron pruebas adicionales para la confirmación de identificaciones de baja probabilidad y se interpretó el perfil de resistencia antibiótica según los puntos de corte recomendados por el CLSI (Ombelet et al., 2021; Clinical and Laboratory Standards Institute, 2023); Para una mejor compresión de los resultados se elaboraron gráficos y tablas donde se expresaron el número y porcentaje de microrganismos que presentan resistencia a los carbapenémicos imipenem, meropenem y ertapenen, así como la presencia de la enzima carbapenemasa KPC, NMD y OXA-48.
RESULTADOS
En la figura 1, se muestra que de las 129 muestras analizadas de pacientes de UCI, las muestras más frecuentes fueron secreciones bronquiales con 60 muestras (46,5%) y las de orina aséptica con 41 muestras (31,8%).
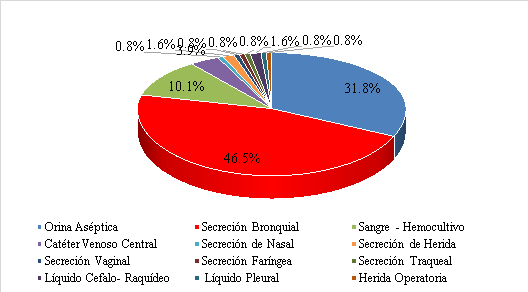
Figura 1. Porcentaje de muestras biológicas procedentes de los pacientes hospitalizados en UCI del del Hospital IV “Víctor Lazarte Echegaray”, durante mayo del 2021 a marzo del 2022.
De las 74 muestras donde se encontró un microorganismo resistente a un carbapenémico Imipenem o Meropenem, analizadas en los pacientes de UCI y que se procesaron en el laboratorio de Diagnóstico de Microbiología del Hospital IV “Víctor Lazarte Echegaray”, durante mayo del 2021 a marzo del 2022; más frecuentes fueron las de secreción bronquial con 43 muestras (56,6%) y las de orina aséptica con 19 muestras (25,7%), tal como se muestra en la Figura 2.
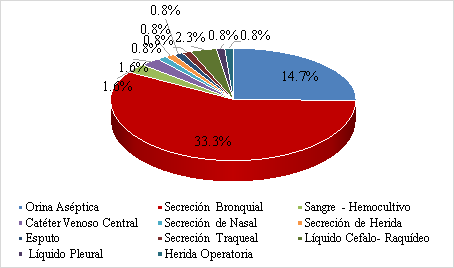
Figura 2. Frecuencia por tipo de muestras biológicas donde se encontró microorganismos resistentes a un carbapenémico Imipenem o Meropenem.
En la figura 3, se puede apreciar a las bacterias resistentes a un carbapenémico imipenem o meropenem, que fueron aisladas a partir de muestras biológicas de los pacientes de UCI , las más frecuentes fueron Klebsiella pneumoniae (31,6%) y Pseudomonas aeruginosa (26,3%).
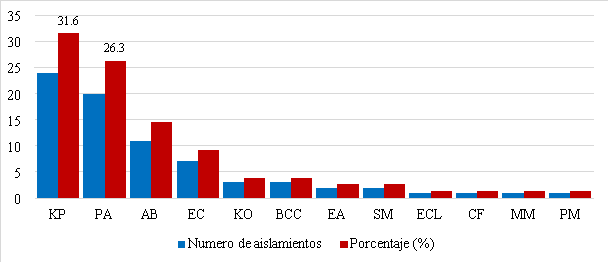
Figura 3. Frecuencia de bacterias resistentes a un carbapenémico imipenem o meropenem, e identificados mediante el sistema automatizado AutoScan-4. Leyenda: KP Klebsiella pneumoniae; PA Pseudomonas aeruginosa; AB Acinetobacter baumannii; EC Escherichia coli; KO Klebsiella oxytoca; BCC Burkholderia cepacia complex; EA Enterobacter aerogenes; SM Serratia marcescens; ECL Enterobacter cloacae; CF Citrobacter freundii; MM Morganella morganii; PM Proteus mirabilis.
Las bacterias resistentes a un carbapenémico imipenem o meropenem, aisladas a partir de muestras de orina aséptica y secreción bronquial de los pacientes de UCI, las más frecuentes fueron Pseudomonas aeruginosa y Klebseiella pneumoniae, tal como se aprecia en la Figura 4.
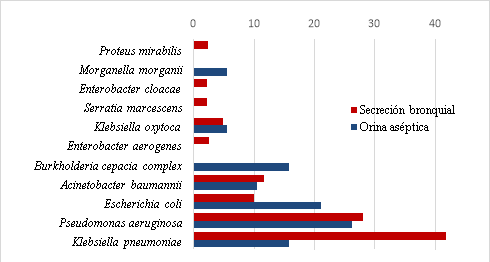
Figura 4. Frecuencia de bacterias resistentes a un carbapenémico imipenem o meropenem, aislados de muestras de orina aséptica y secreción bronquial e identificados mediante el sistema automatizado AutoScan-4.
El tipo de Carbapenemasa presente en Enterobacteriaceae (Orden: Enterobacterales), Pseudomonas aeruginosa y Acinetobacter baumannii resistentes a meropenen e imipenem aisladas de pacientes de UCI, en la Tabla 1 se puede observar, que las más frecuentes fueron las del tipo KPC predominando en los cultivos de Klebsiella pneumoniae y las de tipo NMD en los cultivos de Pseudomonas aeruginosa.
Tabla 1. Frecuencia y porcentaje del tipo de Carbapenemasa presente en Enterobacteriaceae (Orden: Enterobacterales), Pseudomonas aeruginosa y Acinetobacter baumannii resistentes a Meropenen e Imipenem aisladas de pacientes de UCI del Hospital IV “Víctor Lazarte Echegaray, durante mayo del 2021 a marzo del 2022
|
Cultivo bacteriano
|
N° de cultivos
|
(%)
|
Imipenen
|
Meropenen
|
Carbapenemasa
|
|
R
|
S
|
R
|
S
|
KPC
|
NDM
|
OXA-48
|
|
Klebsiella pneumoniae
|
24
|
31,6
|
16
|
8
|
17
|
7
|
24
|
0
|
0
|
|
Pseudomonas aeruginosa
|
20
|
26,3
|
16
|
4
|
20
|
0
|
1
|
11
|
4
|
|
Acinetobacter baumannii
|
11
|
14,5
|
11
|
0
|
11
|
0
|
0
|
6
|
1
|
|
Escherichia coli
|
7
|
9,2
|
6
|
1
|
6
|
1
|
0
|
5
|
2
|
|
Klebsiella oxytoca
|
3
|
3,9
|
3
|
0
|
3
|
0
|
3
|
0
|
0
|
|
Burkholderia cepacia complex
|
3
|
3,9
|
2
|
1
|
3
|
0
|
0
|
1
|
2
|
|
Enterobacter aerogenes
|
2
|
2,6
|
2
|
0
|
2
|
0
|
0
|
0
|
2
|
|
Serratia marcescens
|
2
|
2,6
|
2
|
0
|
2
|
0
|
0
|
0
|
1
|
|
Enterobacter cloacae
|
1
|
1,3
|
1
|
0
|
1
|
0
|
0
|
1
|
0
|
|
Citrobacter freundii
|
1
|
1,3
|
1
|
0
|
1
|
0
|
0
|
0
|
0
|
|
Morganella morganii
|
1
|
1,3
|
1
|
0
|
1
|
0
|
0
|
1
|
0
|
|
Proteus mirabilis
|
1
|
1,3
|
0
|
1
|
1
|
0
|
0
|
0
|
1
|
|
Total
|
76
|
100.0
|
61
|
15
|
68
|
8
|
28
|
25
|
13
|
R = Resistente al antibiótico; S = sensible al antibiótico
DISCUSIÓN
Los resultados obtenidos muestran que, en las 129 muestras analizadas , existe mayor predominio de aislamientos bacterianos en muestras de secreción bronquial (46,5%) y orina (31,8%); del mismo modo la Figura 2, muestra la distribución en base al número de muestras biológicas de donde se aislaron microorganismos resistentes a un carbapenémico imipenem o meropenem; se obtuvo que en las 74 muestras existe mayor predominio de aislamientos bacterianos en muestras de secreción bronquial con 43 muestras (56,6%) y 19 muestras de orina (25,0%).
Los resultados descritos anteriormente se debe a que el mayor predominio de muestras de secreción bronquial proviene del elevado número de pacientes atendidos con infecciones respiratorias agudas durante la emergencia sanitaria del COVID-19, donde se daba prioridad de atención a pacientes sospechosos de haberse infectado con el virus SARS-CoV-2; esta información obtenida concuerdan con lo reportado por Tranche et al. (2021) explicaron el impacto que tuvo la enfermedad COVID-19 en la salud de las personas que buscaban atención en los hospitales durante la primera, segunda y tercera ola de la pandemia del COVID-19; pues en situaciones de la emergencia sanitaria se priorizaba la atención a pacientes que tenían un problema respiratorio agudo y en segundo lugar, se atendía a los demás pacientes incluidos los que tenían alguna enfermedad grave o crónica.
Al analizar los cultivos bacterianos aislados que presentan resistencia a los carbapenemicos imipenem o meropenem (Figura 3), se observó que Klebsiella pneumoniae, Pseudomonas aeruginosa, Acinetobacter spp y Escherichia coli son las bacterias que prevalecen con mayor frecuencia en los cultivos aislados. Estos resultados se asemejan a los obtenidos por Mayta-Barrios et al. (2021) quienes en su estudio sobre caracterización molecular de las carbapenemasas presentes en cultivos provenientes de las 12 regiones del Perú, encontró una prevalencia de 42,2% para Enterobacteraceae, 32,9% para Pseudomonas aeruginosa y 24,9 para Acinetobacter spp.
Cuando se analizaron los cultivos bacterianos aislados por tipo o categoría de muestra (Figura 4), se observó que en las muestras de orina aséptica: Pseudomonas aeruginosa, Escherichia coli y Klebsiella pneumoniae son las que tienen una mayor frecuencia; estos resultados son similares a los reportados por Spiess et al. (2022), quien evidencio prevalencias superiores de hasta un 39,2% para Klebsiella pneumoniae y de un 34,2% para Escherichia coli (Spiess et al.2022); diferentes estudios mencionan que la elevada prevalencia de estos microorganismos en las infecciones urinarias, se suele relacionar o asociar a pacientes vulnerables con largas estancias en los hospitales y uso previo de antibioticoterapia de amplio espectro además en estos pacientes se ha identificado factores de riesgo como la edad, la internación prolongada en UCI, la patología nefrourológica y otras condiciones debilitantes como la inmunosupresión (Garnacho-Montero y Amaya-Villar, 2022).
De la misma manera cuando se analizan las muestras de secreción bronquial (Figura 3), se observa que Klebsiella pneumoniae y Pseudomonas aeruginosa, son las que tienen una mayor frecuencia; tal es así que, de las 43 muestras de secreción bronquial analizadas, se aisló 26 Enterobacterales (60,5%), 12 Pseudomonas aeruginosa (27,9%) y 5 Acinetobacter spp (11,6%); estos resultados concuerdan con la alta frecuencia reportada por Quintero y Varón, (2022), quienes encontraron que el 36,8% de los aislamientos de Klebsiella pneumoniae son multidrogoresistente; reafirmando así que este tipo de infección es un gran problema de salud pública por su asociación a tasas de mortalidad mayores al 50%; además en UCI hay un riesgo alto para desarrollar este tipo de infección debido a que se originan de la misma microbiota de los pacientes, y la estancia hospitalaria así como el tratamiento antibiótico previo alteran la microbiota presente facilitando el crecimiento excesivo de patógeno.
En la Tabla 1, se puede observar el tipo de carbapenemasa presente en las Enterobacterias, Pseudomonas aeruginosa y Acinetobacter baumannii, tal es así que, de los 76 cultivos, 66 cultivos (86,9%) resultaron tener una carbapenemasas que le confiere resistencia a los antimicrobianos imipenem o meropenem, además no se encontró cepas que presenten doble o triple producción de carbapenemasa; estos resultados deben ser tomados con mucha preocupación pues se debe continuar con un programa de vigilancia epidemiológica, ya que partir del 2020, el Ministerio de Salud ha reportado la aparición de una cepa de Acinetobacter baumannii del tipo NDM+OXA-58 y dos cepas de Klebsiella pneumoniae, con doble producción de carbapenemasas del tipo inusual (KPC+NDM) y una cepa inusual de Escherichia coli con doble producción de carbapenemasas (NDM+OXA-48) (OPS/OMS, 2021; Yañez Alvarado, 2021; Ministerio de Salud, 2022).
La frecuencia de las carbapenemasas en el hospital tipo IV de la ciudad de Trujillo (Tabla 1) evidenció que de los 66 cultivos positivos a carbapenemasas, 28 resultaron positivos a tener la enzima KPC (42,4%), 25 a NDM (37,9%) y 13 a OXA-48 (19,7%), siendo las carbapenemas de Clase A y B las que se encuentran con mayor frecuencia en los cultivos aislados. Esta información concuerda con lo mostrado en un estudio realizado en 2019 en el Instituto Nacional de Salud (INS) de Perú en donde se reporta que 185 cepas recolectadas a nivel nacional, presentan enzimas carbapenemasas de Clase A, B y D; siendo la de la Clase B la más frecuente; además reportaron genes como: KPC, NDM, IMP, VIM, OXA-24, OXA-23 (Angles-Yanqui et al., 2020; Mayta-Barrios et al., 2021); haciendo una comparación con un estudio del 2017, reportado en España, se puede observar que entre las carbapenemasas de Clase B, la VIM-2 se detecta con mayor frecuencia; mientras que entre las carbapenemasas de clase A sobresale las de tipo GES y para las de Clase D se encuentra en mayor frecuencia las carbapenemasas de tipo OXA (Oteo et al., 2017).
El conocimiento de los patrones de resistencia a los antimicrobianos, resultan primordiales en la actualidad puesto que se ha observado la aparición de nuevos patógenos multirresistentes a los antimicrobianos y en especial a los carbapenémicos, por lo que brindar una información adecuada y oportuna servirá de gran apoyo al profesional médico para que pueda seleccionar el tratamiento adecuado a fin de lograr la mejoría de los pacientes, la reducción de costos en salud y para evitar la aparición de bacterias multirresistentes a los antimicrobianos (Spiess et al., 2022).
CONCLUSIONES
De un total de 129 cultivos, el 58,9% resultaron ser resistentes al menos a un carbapenémico (Meropenem o Imipenem), de los cuales 59,2% fueron Enterobacteriaceae (Orden Enterobacterales) Escherichia coli (9,2%), Klebsiella oxytoca (3,9), Burkholderia cepacia complex (3,9%), Enterobacter aerogenes y Serratia marcescens (2.6%) Enterobacter cloacae, Citrobacter freundii, Morganella morganii y Proteus mirabilis (1,3%), el 26,3% Pseudomonas aeruginosa y el 14,5% Acinetobacter spp; al evaluar la presencia de carbapenemasas se encontró que 66 cultivos (51,2%) presentaban carbapenemasas; de los cuales 28 son positivos a KPC (42,4%), 25 a NDM (37,9%) y 13 a OXA-48 (19,7%).
REFERENCIAS BIBLIOGRÁFICAS
Ali Abdel Rahim, K. A., & Ali Mohamed, A. M. (2014). Prevalence of Extended Spectrum β-lactamase-Producing Klebsiella pneumoniae in Clinical Isolates. Jundishapur Journal of Microbiology, 7(11), e17114. https://doi.org/10.5812/jjm.17114
Angles-Yanqui, E., Huaringa-Marcelo, J., Sacsaquispe-Contreras, R., & Pampa-Espinoza, L. (2020). Panorama of carbapenemases in PeruUm panorama das carbapenemases presentes no Peru. Revista panamericana de salud publica, 44, e61. https://doi.org/10.26633/RPSP.2020.61
Chicaiza-Taypanta, J. O. (2021). Enterobacterias multirresistentes en infecciones intrabdominales. Investigación clínica, 62, 205+. https://go.gale.com/ps/i.do?id=GALE%7CA686261402&sid=googleScholar&v=2.1&it=r&linkaccess=abs&issn=05355133&p=AONE&sw=w&userGroupName=anon%7E62a8998d
Chicaiza-Tayupanta, J. O., & Chicaiza-Quishpe, A. A. (2021). Perfil de resistencia a los antimicrobianos en enterobacterias causantes de infecciones intraabdominales en pacientes adultos del Servicio de CirugÍa en el Hospital General de Latacunga entre el 1 de junio de 2019 al 31 de mayo del 2020". Investigacion clinica, 62, 216+. https://go.gale.com/ps/i.do?id=GALE%7CA686261403&sid=googleScholar&v=2.1&it=r&linkaccess=abs&issn=05355133&p=AONE&sw=w&userGroupName=anon%7Eedeeab8e
Clinical and Laboratory Standards Institute. (2023). M100. Performance Standards for Antimicrobial Susceptibility Testing. 33rd. Clinical and Laboratory Standards Institute. https://clsi.org/standards/products/microbiology/documents/m100/
Coris Bio Concept. (2023). Prueba rápida de diagnóstico in vitro para la detección de carbapenemasas OXA-48, KPC y NDM en cultivos bacterianos. https://s3-qrd-prd-docs.s3.eu-west-1.amazonaws.com/corisbio/documents/b4c612aa-e66d-4a04-ab7b-e6caea876e43.pdf?response-content-disposition=filename%3D%22D-IFU-R5%2BRESIST-3%2BO.pdf
Garnacho-Montero, J., & Amaya-Villar, R. (2022). El problema de la multi-resistencia en bacilos gram-negativos en las unidades de cuidados intensivos: estrategias de tratamiento y prevención. Medicina intensiva, 46(6), 326-335. https://doi.org/10.1016/j.medin.2021.12.002
Gobernado, M. (2010). Meropenem. Aspectos microbiológicos. Revista Española de Quimioterapia, 23(1), 02-17. https://seq.es/wp-content/uploads/2010/07/gobernado.pdf
Instituto de Salud Carlos III (ISCIII). (2021). PROTOCOLOS RED DE LABORATORIOS PARA LA VIGILANCIA DE LOS MICROORGANISMOS RESISTENTES (RedLabRA): Detección fenotípica de enterobacterias productoras de carbapenemasas y pruebas de hidrólisis antibiótica (carbapenémico) e inmunocromatográficas. https://www.isciii.es/QueHacemos/Servicios/DiagnosticoMicrobiol%C3%B3gicoyProgramasVigilancia/Documents/RedLabRa-I-003-01.%20Protocolo_fenotipo_carba.pdf
Josa-Montero, D., Yusef-Mejía, S., Julián Forero, A., Leal, R., Rojas, J., & Esparza, G. (2021). Colonización rectal por Enterobacterales productores de múltiples carbapenemasas: Reporte de un caso de coproducción. Infectio: revista de la Asociacion Colombiana de Infectologia, 25(3), 193. https://doi.org/10.22354/in.v25i3.947
León-Luna, D., Fajardo-Loyola, A., Yareta-Yareta, J., Burgos-Espejo, A., Peralta-Siesquen, C., Galarza-Pérez, M., & Marcos-Carbajal, P. (2021). Caracterización molecular de enterobacterias multirresistentes en dos departamentos de la selva peruana. Biomedica: Revista Del Instituto Nacional de Salud, 41(Sp. 2), 180-187. https://doi.org/10.7705/biomedica.5720
Lepe, J. A., & Martínez-Martínez, L. (2022). Mecanismos de resistencia en bacterias gramnegativas. Medicina intensiva, 46(7), 392-402. https://doi.org/10.1016/j.medin.2022.02.004
March-Rosselló, G. A. (2017). Métodos rápidos para la detección de la resistencia bacteriana a antibióticos. Enfermedades Infecciosas y Microbiologia Clinica, 35(3), 182-188. https://doi.org/10.1016/j.eimc.2016.12.005
Mayta-Barrios, M. M., Ramirez-Illescas, J. J., Pampa-Espinoza, L., & Yagui-Moscoso, M. J. A. (2021). Caracterización molecular de carbapenemasas en el Perú durante el 2019. Revista peruana de medicina experimental y salud publica, 38(1), 113-118. https://doi.org/10.17843/rpmesp.2021.381.5882
Ministerio de Salud. (2022). ALERTA EPIDEMIOLÓGICA: Riesgo de infecciones asociadas a la atención de la salud causadas por Enterobacterales, Pseudomonas aeruginosa y Acinetobacter spp. coproductoras de carbapenemasas en el Perú. https://www.hospitalhuaycan.gob.pe/SIESMAR/Archivos/epidemiologia/3.2.0.0/Alertas_Epidemiologicas-250422233056918.pdf
Oteo, J., Bou, G., Chaves, F., & Oliver, A. (2017). Métodos microbiológicos para la vigilancia del estado de portador de bacterias multirresistentes. Enfermedades infecciosas y microbiologia clinica, 35(10), 667-675. https://doi.org/10.1016/j.eimc.2015.12.013
Quintero Meza, E. V., & Varón Rodríguez, C. (2022). Caracterización de la colonización por Klebsiella pneumoniae resistentes a Carba-penémicoc en pacientes provenientes de UCI. Universidad El Bosque. Edu.co. https://repositorio.unbosque.edu.co/bitstream/handle/20.500.12495/9132/MDRO%20pacientes%20UCI%20TESIS.pdf?sequence=1&isAllowed=y
Rada, A. M., Hernández-Gómez, C., Restrepo, E., & Villegas, M. V. (2019). Distribución y caracterización molecular de betalactamasas en bacterias Gram negativas en Colombia, 2001-2016. Biomedica: Revista Del Instituto Nacional de Salud, 39(s1), 199-220. https://doi.org/10.7705/biomedica.v39i3.4351
Sacsaquispe-Contreras, R., & Bailón-Calderón, H. (2018). Identification of carbapenem-resistant genes in enterobacteria from peruvian hospitals, 2013-2017. Revista peruana de medicina experimental y salud publica, 35(2), 259-264. https://doi.org/10.17843/rpmesp.25Y.25v25i.3474
Spiess, J., Fernández, I., Gadea, P., Romero, S., Spiess, C., Seija, V., & Ormaechea, G. (2022). Infecciones urinarias nosocomiales en un hospital universitario: prevalencia, factores predisponentes y agentes etiológicos en salas de cuidados moderados. INNOTEC, 7(3), 4-15. https://doi.org/10.26445/07.03.1
Struthers, K. (2018). Microbiología clínica. Editorial El Manual Moderno.
Tranche Iparraguirre, S., Martín Álvarez, R., Párraga Martínez, I., & Junta Permanente y Directiva de la semFYC. (2021). El reto de la pandemia de la COVID-19 para la Atención Primaria. Revista clínica de medicina de familia, 14(2), 85-92. https://doi.org/10.55783/rcmf.140208
Vinicoff, G., Díaz, N., Zubeldía Brenner, L., Ezcurra, M. C., & Farina, J. (2022). Epidemiología de las infecciones asociadas al cuidado de la salud y consumo de antibióticos en pandemia covid 19. Publicación Científica del Hospital Cuenca Alta Nestor Kirchner, 1(1). https://docencia.hospitalcuencaalta.org.ar/public_html/ojs/index.php/HCANK/article/view/9
Worku, M., Getie, M., Moges, F., & Mehari, A. G. (2022). Extended-spectrum beta-lactamase- and carbapenemase-producing Enterobacteriaceae family of bacteria from diarrheal stool samples in Northwest Ethiopia. Interdisciplinary Perspectives on Infectious Diseases, 2022, 7905350. https://doi.org/10.1155/2022/7905350
Yañez Alvarado, E. M. (2021). BOLETÍN EPIDEMIOLÓGICO DEL PERÚ 2021: Vol. 30. SE-51 (Ministerio de Salud & Centro Nacional de Epidemiología Prevención y Control de Enfermedades, Eds.). Red Nacional de Epidemiología (RENACE). https://www.dge.gob.pe/epipublic/uploads/boletin/boletin_202151_27_134823.pdf
Zurita Macalupú, S., Ministerio de Salud, & Instituto Nacional de Salud. (2013). Manual de Procedimientos de laboratorio: laboratorios locales I: laboratorios locales II. https://bibliotecavirtual.insnsb.gob.pe/manual-de-procedimientos-de-laboratorio-laboratorios-locales-i-laboratorios-locales-ii/
![]() * y Christian Rivera- Salazar[2]
* y Christian Rivera- Salazar[2]![]()



