INTRODUCCIÓN
La leche es un alimento nutritivo y perecible, debido a su alto contenido de agua, a su contenido de proteínas de alto valor biológico y carbohidratos (D’Incecco et al., 2021); y por ello mismo posee una limitada vida principalmente debido a su contenido de una compleja microbiota que provocan el deterioro de la leche al producir lipasas y proteasas extracelulares (de Oliveira et al., 2015) y dentro de esta microbiota se ha demostrado que en almacenamiento refrigerado pueden aumentar Pseudomonas, Staphylococcus aureus y los coliformes totales (Ribeiro-Júnior et al., 2020; Lemma et al., 2021; Mladenovic et al., 2021).
Por ello el tratamiento térmico suele ser el método más usado para preservar la calidad y seguridad de la leche, debiéndose usar temperaturas bajas en su pasterización para minimizar las pérdidas de calidad (Wang et al., 2021); pero debido a esta limitación en la temperatura hace que la inactivación de bacterias y de enzimas termo resistentes sea limitada reduciendo la vida útil de la leche (Yu et al., 2022). Las tecnologías emergentes como los ultrasonidos de alta potencia se están investigando como reemplazo a las tecnologías térmicas en leche y productos lácteos (Jiménez-Sánchez et al., 2017); pero con resultados poco satisfactorios (Soltani et al., 2022) o francamente contradictorios (Lim et al., 2019); de ahí la necesidad de plantear el uso de ultrasonidos desde un enfoque nuevo, donde los ultrasonidos sean parte de un sistema de barreras que aproveche sus ventajas (mayor eficiencia a energética, aplicación a baja temperatura y ecológicamente amigable) (Juraga et al., 2021) y minimice sus desventajas (producción de olores extraños, incremento de la oxidación por generación de radicales libres, etc.) (Marchesini et al., 2015).
Así el objetivo de la presente investigación es evaluar la estabilización de leche fresca pre sonicada y sometida a tratamientos térmicos de baja temperatura a través de los efectos del proceso sobre la población microbiana de gérmenes Aerobios Mesófilos Viables y Coliformes Totales.
MATERIALES Y MÉTODOS
La investigación se ejecutó en el Laboratorio de Tecnología de Alimentos de la Universidad Nacional Pedro Ruiz Gallo.
Recepción de leche fresca
Las muestras de leche fueron acopiadas del segundo ordeño de la cuenca lechera de la zona de Lambayeque. Fueron recepcionadas en envases plásticos de primer uso, lavados, secados, esterilizados con alcohol al 70%, secados al ambiente y mantenidos cerrados. Una vez recepcionada la muestra en los envases, esta fue transportada en una caja de poliestireno expandido cerrada con gel de refrigeración a 10 °C y colocadas en refrigeración a 5 °C por no más de 12 horas hasta su uso experimental.
Tratamiento ultrasónico de leche fresca
La muestra de leche fresca fue separada en muestras de 250 ml en frascos de vidrio con tapa plástica de 350 ml pre esterilizados a 121 °C por 15 minutos; y en forma aleatoria fueron sometidas a tratamientos de ultrasonidos en un sonicador modelo PZ-550LI (Fangxu Technology Co., Ltd, China) equipado con sonda de 6 mm de diámetro modelo T1-6AL-4V en acero al titanio, trabajando a 24 kHz, con un aporte de 25 watts de energía ultrasónica real y que trabaja con una amplitud de 100 µm.
Las muestras de leche fueron tratadas hasta alcanzar un tratamiento ultrasónico de 0.5 kJ/mL a una temperatura constante de 20 °C, posterior a lo cual fueron enfriadas rápidamente a 10 °C y mantenidas no más de 2 horas antes de la aplicación del tratamiento térmico a las temperaturas a ensayar.
Tratamiento Térmico de leche fresca pre sonicada
Las muestras de leche pre sonicadas en sus frascos de sonicación cerrados y refrigerados fueron atemperadas bajo chorro de agua y en agitación constante; posteriormente fueron colocadas en un baño maría digital con microprocesador Modelo HH-1 (Jiaxing Junsi Electronics Co., Ltd, China) calibrado a las temperaturas a ensayar. Uno de los frascos (que no fue muestreado) quedo abierto para la evaluación de la temperatura interna que fue monitoreada por un datalogger DTM-319 (Tecpel Inc, Taiwan) equipado con una Termocupla TECPEL modelo TPK-03S calibrado de fábrica (SN TP16K2337), que fue colocada dentro de la leche durante el proceso térmico; el tiempo de tratamiento térmico empezó a tomarse al llegar la leche pre sonicada a la temperatura de tratamiento.
Por otro lado una muestra de leche fresca de vaca cruda sin pre tratamiento de sonicación fue sometida a pasterización térmica convencional por 30 minutos a 60 °C siguiendo el procedimiento anteriormente mencionado para muestra de comparación.
Terminado el tiempo de tratamiento térmico del ensayo, los frascos fueron retirados del baño maría y sumergidos en agitación en un baño de hielo a 0 °C y posteriormente refrigerados hasta su análisis por no más de 12 horas de almacenamiento.
Las temperaturas de tratamiento térmico y los tiempos de muestreo se presentan en el Tabla 1
Tabla 1. Temperaturas y Tiempos de muestreo de Tratamiento Térmico de Leche Pre Sonicada
|
Temperatura (°C)
|
Tiempo de Retención (min) para muestreo
|
|
40
|
0
|
4
|
8
|
16
|
24
|
|
45
|
0
|
4
|
8
|
16
|
24
|
|
50
|
0
|
2
|
4
|
8
|
16
|
|
55
|
0
|
2
|
4
|
8
|
16
|
|
60
|
0
|
1
|
2
|
4
|
6
|
Análisis Microbiológicos de Leche Pre Sonicada y con Tratamiento Térmico
Aerobios Mesófilos Viables (AMV)
El número de gérmenes aeróbios mesófilos viables se determinó tomando muestras de 10 mL de leche pre sonicada y tratadas a diferentes temperaturas y se prepararon diluciones seriadas decimales con solución salina peptonada (0.1% Peptona de Carne y 0.85% de Cloruro de Sodio en agua destilada esterilizada a 121 °C por 15 minutos) hasta diluciones decimales de 10-1 hasta 10-5, se agitaron en un agitador vortex por 15 segundos. Se pipeteó 1 ml de cada dilución que se depositó en una Placa Petri estéril, enseguida se vertió 15 ml de Agar Plate Count (Merck, USA), se dispersó la muestra con movimientos circulares. Las placas solidificadas se incubaron por 48 horas a 35 +/- 1 °C. Se retiraron las placas, se determinó el número de colonias formadas; y a partir de la dilución inoculada se calculó el número de ufc/mL de muestra, ello según el método propuesto por Maturin y Peeler (2021).
Coliformes Totales (CT)
El contenido de Coliformes Totales se determinó tomando muestras de 10 ml de leche pre sonicada y tratadas a diferentes temperaturas y preparándolas en diluciones seriadas decimales con solución salina peptonada (0.1% Peptona de Carne y 0.85% de Cloruro de Sodio en agua destilada esterilizada a 121 °C por 15 minutos) hasta diluciones decimales de 10-1 hasta 10-5 , se agitó en un agitador vortex por 15 segundos, se pipeteó 1 mL de cada dilución que se depositó en una Placa Petri estéril, enseguida se vertió 15 mL de Violet Red Bile Agar (VRBA) (Merck, USA), se dispersó la muestra con movimiento circulares. Las placas solidificadas se incubaron por 48 horas a 35 +/- 1 °C. Se retiraron las placas de la incubadora y utilizando un cuenta colonias se determinó el número de colonias formadas; y a partir de la dilución inoculada se calculó el número de ufc/ml de muestra, ello según el método propuesto por Feng et al. (2021).
Técnicas de Procesamiento y Análisis de Datos
Modelamiento Matemáticos de Datos Microbiológicos
Los resultados de la evaluación de AMV y de CT; fueron modelados utilizando el modelo de Bigelow de temperatura constante (ecuación 1), según lo indicado por Wei et al. (2020)
La ecuación clave del modelo es:
Nt=No+(b*t) (1)
El cálculo de los parámetros No y b se realizó utilizando una regresión lineal con ajuste a mínimos cuadrados en el software MS Excel (Microsoft Corporation, USA). Los valores D y z para Coliformes fueron calculados según lo indicado por Solano-Cornejo (2013) y Dash et al., (2022), donde:
Dt = tf / (Nf / No) (2)
z = (T1-T2) / log (D1/D2) (3)
Dónde:
Nt = Población microbiana (log ufc/mL) al tiempo t
Df = valor D a una temperatura dada (min-1)
z = Valor z por tipo de microorganismo ( °C)
Nf = Población microbiana (log ufc/mL) al final del tratamiento térmico
No = Población microbiana inicial (log ufc/mL)
b = Pendiente de la curva de muerte microbiana ((log ufc/mL) / min)
t = Tiempo de Tratamiento Térmico (min)
T1 y T2= Temperaturas de Tratamiento Térmico ( °C)
D1 y D2= Valores D a las temperaturas 1 y 2 (min-1)
Modelamiento Matemático de Parámetro b
Los valores b del Modelo de Bigelow para los AMV o CT; fueron modelados utilizando un modelo Polinómico de grado 2 o 3 dependiendo del mejor ajuste en el coeficiente R2 para temperaturas variables (ecuación 4), según lo indicado por Abdullah et al. (2019)
La ecuación clave del modelo es:
bt=At3+Bt2+Ct+D (4)
Dónde:
bt = Pendiente de la curva de muerte microbiana ((log ufc/mL) / min) a la temperatura t
A, B, C, D = Raíces del Modelo Polinómico
El cálculo de las raíces del modelo polinómico para el parámetro b se realizó utilizando una regresión polinómica con ajuste a mínimos cuadrados en el software MS Excel (Microsoft Corporation, USA).
RESULTADOS
Efecto de tratamiento térmico sobre Aerobios Mesófilos Viables (AMV) en leche pre sonicada.
El efecto de diferentes tratamientos térmicos sobre la población de Aerobios Mesófilos Viables (AMV) en la leche pre tratada por ultrasonidos se presenta en el Tabla 2.
La población inicial de Aerobios Mesófilos Totales en leche cruda fue de 3.600 (± 0.086) log ufc/ml; mientras que a la población final de AMV en leche con pasterización convencional fue de 1.462 (± 0.228) log ufc/ml.
Tabla 2. Promedio y Desviación Estándar de conteo de Aerobios Mesófilos Viables (AMV) (log ufc/mL) en leche pre sonicada (0.5 kJ/mL) y tratada a diferentes temperaturas.
|
Temperatura (°C)
|
Tiempo de Tratamiento (min) a temperatura constante
|
|
|
0
|
4
|
8
|
16
|
24
|
|
40
|
2.876 ± 0.053
|
2.999 ± 0.424
|
3.185 ± 0.464
|
3.015 ± 0.158
|
3.122 ± 0.205
|
|
45
|
2.839 ± 0.075
|
3.141 ± 0.029
|
3.31 ± 0.029
|
3.195 ± 0.115
|
3.403 ± 0.017
|
|
|
0
|
2
|
4
|
8
|
12
|
|
50
|
2.895 ± 0.02
|
2.473 ± 0.421
|
2.778 ± 0.137
|
3.132 ± 0.301
|
3.068 ± 0.281
|
|
55
|
2.823 ± 0.014
|
2.462 ± 0.116
|
2.777 ± 0.041
|
2.898 ± 0.120
|
2.665 ± 0.402
|
|
|
0
|
1
|
2
|
4
|
6
|
|
60
|
2.854 ± 0.128
|
2.816 ± 0.005
|
2.610 ± 0.314
|
2.278 ± 0.393
|
1.716 ± 0.337
|
Se observó que la población de AMV en leche pre sonicada a 0.5 kJ/mL respondió de forma variable a las temperaturas ensayadas (40 a 60 °C) presentando crecimiento en el rango de 40 a 50 °C, no crecimiento a 50° C e inactivación a 60 °C.
Este cambio de incremento población a disminución poblacional es concordante con los bajos coeficientes R2 encontrados en el modelamiento y presentados en el Tabla 3; salvo cuando ya el proceso de inactivación se ha iniciado a 60 °C donde el R2 es alto. Lo cual confirma que el modelo de Bigelow es un modelo preciso para inactivación microbiana y no debiendo usarse para situaciones donde puede presentarse estancamiento o crecimiento microbiano, tal como indica Wei et al. (2020) al analizar la inactivación microbiana de Salmonella spp. baja humedad.
Tabla 3. Parámetros Cinéticos (Modelo de Bigelow) para Aerobios Mesófilos Viables en leche pre sonicada (0.5 kJ/mL) a diferentes tratamientos térmicos
|
Temperatura de Tratamiento (°C)
|
Parámetros Cinéticos
|
|
Intercepto (No)
|
Pendiente (b)
|
R2
|
|
40
|
2.967
|
0.007
|
0.319
|
|
45
|
2.993
|
0.018
|
0.636
|
|
50
|
2.683
|
0.036
|
0.436
|
|
55
|
2.706
|
0.004
|
0.011
|
|
60
|
2.956
|
-0.193
|
0.966
|
|
|
|
|
|
Por otro lado, al modelar el parámetro b (Pendiente de curva de muerte) con respecto a las temperaturas ensayadas se observó que a temperaturas por debajo de 50°C el tratamiento térmico tendía a incrementar la población; y que por encima de 50 °C la población tendía a crecer más lentamente y finalmente a entrar en inactivación, tal como se aprecia en la Figura 1.
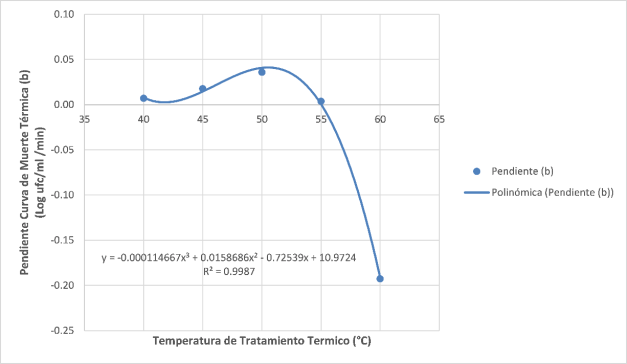
Figura 1 Parámetro b (Modelo Bigelow) en leche pre sonicada (0.5 kJ/mL) con diferentes temperaturas de tratamiento térmico para Aerobios Mesófilos Viables
De la resolución de la ecuación polinómica se obtiene que la temperatura critica para el inicio de la inactivación de los AMV en leche pre sonicada es de 55.04 °C.
Efecto de tratamiento térmico sobre Coliformes Totales (CT) en leche pre sonicada.
El efecto de diferentes tratamientos térmicos sobre la población de Aerobios Mesófilos Viables (AMV) en la leche pre tratada por ultrasonidos se presenta en el Tabla 4.
La población inicial de Coliformes Totales en leche cruda fue de 2.461 (± 0.084) log ufc/ml; mientras que a la población final de Coliformes Totales en leche con pasterización convencional fue de -1.00 (± 0.001) log ufc/ml.
Tabla 4. Promedio y Desviación Estándar de conteo de Coliformes Totales (CT) (log ufc/mL) en leche pre sonicada (0.5 kJ/mL) y tratada a diferentes temperaturas.
|
Temperatura (°C)
|
Tiempo de Tratamiento (min) a temperatura constante
|
|
|
0
|
4
|
8
|
16
|
24
|
|
40
|
2.009 ± 0.149
|
2.414 ± 0.047
|
2.582 ± 0.128
|
2.803 ± 0.077
|
3.029 ± 0.170
|
|
45
|
1.988 ± 0.047
|
2.203 ± 0.038
|
2.476 ± 0.162
|
2.492 ± 0.241
|
2.594 ± 0.633
|
|
|
|
|
|
|
|
|
|
0
|
2
|
4
|
8
|
12
|
|
50
|
1.929 ± 0.036
|
1.923 ± 0.110
|
1.866 ± 0.125
|
1.916 ± 0.019
|
1.690 ± 0.125
|
|
55
|
1.938 ± 0.337
|
1.889 ± 0.157
|
1.739 ± 0.056
|
1.540 ± 0.088
|
1.423 ± 0.172
|
|
|
|
|
|
|
|
|
|
0
|
1
|
2
|
4
|
6
|
|
60
|
1.943 ± 0.139
|
1.690 ± 0.125
|
1.389 ± 0.125
|
1.000 ± 0.426
|
0.588 ± 0.157
|
Como se observó anteriormente en el caso de AMV las temperaturas más bajas ensayadas muestran incremento poblacional (40 y 45 °C); pero por encima de ellas ya el tratamiento térmico muestra reducción poblacional de CT por efecto del proceso térmico en leche pre sonicada.
Así mismo se observan inicios de inactivación en el rango entre 45 y 50 °C con reducciones poblacionales de Coliformes Totales al término del proceso térmico.
Así mismo la concentración poblacional de Coliformes Totales (CT) en leche pre sonicada (0.5 kJ/mL) durante el tratamiento térmico a diferentes temperaturas fue modelada usando el Modelo de Bigelow de temperatura constante; y los parámetros cinéticos determinados se presenta en el Tabla 5.
Tabla 5. Parámetros Cinéticos (Modelo de Bigelow) para Coliformes Totales (CT) en leche pre sonicada (0.5 kJ/mL) a diferentes tratamientos térmicos
|
Temperatura de Tratamiento (°C)
|
Parámetros Cinéticos
|
|
Intercepto (No)
|
Pendiente (b)
|
R2
|
|
40
|
2.1649
|
0.0387
|
0.9184
|
|
45
|
2.1121
|
0.0229
|
0.7864
|
|
50
|
1.9523
|
-0.0168
|
0.6482
|
|
55
|
1.9421
|
-0.0455
|
0.9791
|
|
60
|
1.9038
|
-0.2237
|
0.9940
|
Se puede observar que a pesar que el Modelo de Bigelow no es un modelo para crecimiento microbiano, en este caso; si presenta valores de R2 robustos para situaciones en las que el tratamiento térmico ha generado crecimiento (40 y 45 °C); sin embargo, a 50 °C el R2 este cae a su valor más bajo; retornando a valores altos cuando el proceso de inactivación ya es firme, como lo confirman las Pendientes (b) negativas indicadores de curvas de inactivación microbiana.
También se observó que conforme la temperatura de tratamiento se incrementaba por encima de 45 °C los valores de la Pendiente (b) disminuían, tal como se aprecia en la Figura 2.
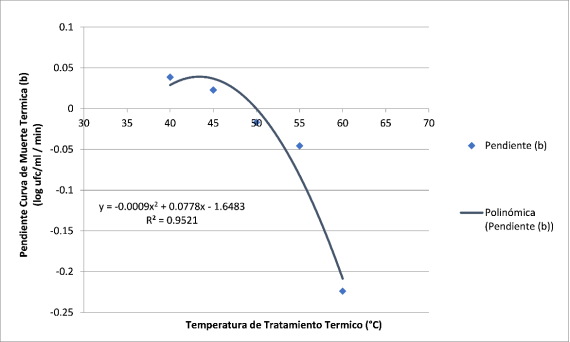
Figura 2 Parámetro b (Modelo Bigelow) en leche pre sonicada (0.5 kJ/mL) con diferentes temperaturas de tratamiento térmico para Coliformes Totales
Al modelar la Pendiente (b) con referencia a la temperatura con un modelo polinómico de 2 grado; y al resolver el modelo para una pendiente cero se determinó que la temperatura de inicio de inactivación térmica en leche pre sonicada a 0.5 kJ/mL para CT fue de 49.28 °C.
Por otro lado los valores D del Modelo de Bigelow fueron obtenidos y se presentan en el Tabla 6.
Tabla 6. Valores D y z para Coliformes Totales en leche pre sonicada (0.5 kJ/mL) a diferentes temperaturas
|
T (°C)
|
Valor D (min)
|
Log D
|
|
50
|
50.302
|
1.702
|
|
55
|
23.302
|
1.367
|
|
60
|
4.427
|
0.646
|
|
Valor z
|
9.475
|
°C
|
|
|
|
|
DISCUSIÓN
Efecto del Tratamiento Térmico en leche pre sonicada sobre Aerobios Mesófilos Viables (AMV)
Durante los ensayos de tratamiento térmico se encontró que conforme la temperatura de tratamiento aumentó, los AMV fueron decreciendo y también a medida que el tiempo de tratamiento isotérmico se prolongaba. Este cambio de una tasa de variación poblacional positiva a negativa es concordante con lo reportado por Myer et al. (2016) para P. fluorescens y L. fermentum en pasterización de Corto Tiempo y Baja Temperatura (BTBT); quien indica que conforme la temperatura de tratamiento aumenta la población desciende; ambos géneros (Pseudomonas spp. y Lactobacillus spp.) están comprendidos dentro de los gérmenes Aerobios Mesófilos Viables en leche tal como indica Ksontini et al. (2011).
Visto el efecto variable de la temperatura, se observó que conforme la temperatura de tratamiento térmico se incrementaba, la Pendiente (b) de la recta del modelo de Bigelow empezaba a declinar; por lo que obteniendo y resolviendo la primera derivada de la ecuación del modelo se determinó que el descenso del parámetro b empieza a 50.52 °C como puede observarse en la figura 01.
Por otro lado, la pendiente de la recta (b) permitió determinar la temperatura crítica de inicio de la inactivación microbiana. Así, graficando la pendiente en función de la temperatura, se obtuvo que la temperatura crítica para iniciar el efecto antimicrobiano en AMV por tratamiento térmico fue de 55.04 °C (Figura 1).
Si comparamos esta temperatura de inicio de inactivación con las temperaturas utilizadas en pasterización reportadas por Sarkar (2015) para géneros de AMV como Bacillus spp. (95 °C) y Staphylococcus spp. (65 °C), podemos verificar que la aplicación previa de un tratamiento ultrasónico (0.5 kJ/mL) logro aumentar la sensibilidad térmica de AMV, lo cual está relacionado a la generación de un daño subletal por ultrasonidos lo que aumenta la sensibilidad térmica de los microorganismos tal como indica Chen et al. (2020); este efecto de los ultrasonidos en leche permitiría realizar procesos de pasterización a temperaturas más bajas y reducir los efectos negativos de la pasterización puramente térmica o ultrasónica.
Así mismo, la aplicación de los tratamientos térmicos a 60 °C por 6 minutos en leche pre sonicada permitió reducir la población de AMV a 1.716 ± 0.337 log ufc/mL; por lo que la muestra de leche alcanzó la calidad de pasterizada según los criterios microbiológicos nacionales del MINSA que requieren que la población máxima de AMV sea de 2 log ufc/mL.
Efecto del Tratamiento Térmico en leche pre sonicada sobre Coliformes Totales (CT)
Durante los ensayos con tratamientos s diferentes temperaturas se pudo determinar que temperaturas entre 40 y 45 °C se produjo aumento poblacional en los CT, sin embargo los ensayos a partir de 50 °C mostraron reducciones poblacionales más rápidas conforme la temperatura se incrementaba. De esta manera el efecto de inactivación térmica de CT en leche pre sonicada empezó a los 49.28 °C lo que mostraría un aumento en la sensibilidad térmica en los CT por sonicación concordante con lo indicado por Chen et al. (2020).
Este aumento del efecto de inactivación térmica para Coliformes Totales por pre sonicación de leche se confirma al comparar los valores D60°C con los reportados por Peng et al. (2013) quien indica D60°C para Escherichia coli en leche cruda con un rango de 21.9 a 80.5 min; mientras que en leche pre sonicadas el valor D60°C es de 4.49 min. Los resultados confirman lo indicado por Liao et al., (2018) quien reporta que la sensibilización al calor se debe a la presencia de células microbianas dañadas subletalmente por efecto de los ultrasonidos; y que conforme el tratamiento ultrasónico se prolongaba la proporción de células dañadas subletalmente aumentaba; lo cual es visible en los resultados presentados.
CONCLUSIONES
La aplicación de tratamiento ultrasónicos de 0.5 kJ/mL previos a tratamientos térmicos produce el aumento de la sensibilidad térmica de AMV y CT permitiendo inactivaciones a temperaturas más bajas y con mayor rapidez que las temperaturas convencionalmente utilizadas en pasterización de leche.
La aplicación de ultrasonidos en leche a densidades energéticas de 0.5 kJ/mL permite iniciar procesos de inactivación microbiana de AMV a 55.04 °C y en el caso de CT a 49.28°C, valores por debajo de los reportados por la literatura para pasterización de leche.
El aumento de la sensibilidad térmica en leche pre sonicada estaría ligada a la producción de daños sub letales en las células de AMV y CT lo que acelera su inactivación térmica, y permitiría realizar pasterizaciones de leche a más bajas temperaturas reduciendo significativamente los efectos deletéreos de los tratamientos térmicos y alcanzando a estabilizar microbiológicamente la leche fresca.
AGRADECIMIENTOS
La presente investigación se desarrolló en el marco del proyecto de investigación doctoral del Programa de Posgrado - Doctorado de Ingenieria de Alimentos de la Universidad Nacional de Santa, aprobado por Resolución Directoral 318-2022-EPG-UNS
REFERENCIAS BIBLIOGRÁFICAS
Abdullah, S. N., You, K. Y., Khamis, N. H., & Cheong Y, C. (2019). Modelling the Dielectric Properties of Cow’s Raw Milk under Vat Pasteurization. Progress In Electromagnetics Research Materials, 84, 157–166.
Chen, F., Zhang, M., & Yang, C. hui. (2020). Application of ultrasound technology in processing of ready-to-eat fresh food: A review. In Ultrasonics Sonochemistry (Vol. 63). https://doi.org/10.1016/j.ultsonch.2019.104953
D’Incecco, P., Limbo, S., Hogenboom, J. A., & Pellegrino, L. (2021). Novel technologies for extending the shelf life of drinking milk: Concepts, research trends and current applications. Lwt, 148(May), 111746. https://doi.org/10.1016/j.lwt.2021.111746
Dash, K. K., Fayaz, U., Dar, A. H., Shams, R., Manzoor, S., Sundarsingh, A., Deka, P., & Khan, S. A. (2022). A comprehensive review on heat treatments and related impact on the quality and microbial safety of milk and milk-based products. Food Chemistry Advances, 1(May), 100041. https://doi.org/10.1016/j.focha.2022.100041
de Oliveira, G. B., Favarin, L., Luchese, R. H., & McIntosh, D. (2015). Psychrotrophic bacteria in milk: How much do we really know? Brazilian Journal of Microbiology, 46(2), 313–321. https://doi.org/10.1590/S1517-838246220130963
Feng, P., Weagant, S. D., & Grant, M. A. (2021). BAM Chapter 4: Enumeration of Escherichia coli and the Coliform Bacteria. Bacteriological Analytical Manual (BAM). https://www.fda.gov/food/laboratory-methods-food/bam-chapter-4-enumeration-escherichia-coli-and-coliform-bacteria
Jiménez-Sánchez, C., Lozano-Sánchez, J., Segura-Carretero, A., & Fernández-Gutiérrez, A. (2017). Alternatives to conventional thermal treatments in fruit-juice processing. Part 1: Techniques and applications. Critical Reviews in Food Science and Nutrition, 57(3), 501–523. https://doi.org/10.1080/10408398.2013.867828
Juraga, E., Vukušić Pavičić, T., Gajdoš Kljusurić, J., Brnčić, M., Juraga, T., & Herceg, Z. (2021). Properties of milk treated with high-power ultrasound and bactofugation. Food Technology and Biotechnology, 59(1), 92–102. https://doi.org/10.17113/ftb.59.01.21.6721
Ksontini, H., Kachouri, F., & Hamdi, M. (2011). Microflora distribution and assessment of microbiological quality milk from Tunisian collection centres. African Journal of Microbiology Research, 5(12), 1484–1491.
Lemma, F., Alemayehu, H., Stringer, A., & Eguale, T. (2021). Prevalence and Antimicrobial Susceptibility Profile of Staphylococcus aureus in Milk and Traditionally Processed Dairy Products in Addis Ababa, Ethiopia. BioMed Research International, 2021. https://doi.org/10.1155/2021/5576873
Liao, X., Li, J., Suo, Y., Chen, S., Ye, X., Liu, D., & Ding, T. (2018). Multiple action sites of ultrasound on Escherichia coli and Staphylococcus aureus. Food Science and Human Wellness, 7(1), 102–109. https://doi.org/10.1016/j.fshw.2018.01.002
Lim, S. Y., Benner, L. C., & Clark, S. (2019). Neither thermosonication nor cold sonication is better than pasteurization for milk shelf life. Journal of Dairy Science, 102(5), 3965–3977. https://doi.org/10.3168/jds.2018-15347
Marchesini, G., Fasolato, L., Novelli, E., Balzan, S., Contiero, B., Montemurro, F., Andrighetto, I., & Segato, S. (2015). Ultrasonic inactivation of microorganisms: A compromise between lethal capacity and sensory quality of milk. Innovative Food Science and Emerging Technologies, 29, 215–221. https://doi.org/10.1016/j.ifset.2015.03.015
Maturin, L., & Peeler, J. T. (2021). BAM Chapter 3: Aerobic Plate Count. Bacteriological Analytical Manual (BAM). https://www.fda.gov/food/laboratory-methods-food/bam-chapter-3-aerobic-plate-count
Myer, P. R., Parker, K. R., Kanach, A. T., Zhu, T., Morgan, M. T., & Applegate, B. M. (2016). The effect of a novel low temperature-short time (LTST) process to extend the shelf-life of fluid milk. SpringerPlus, 5(1), 1–12. https://doi.org/10.1186/s40064-016-2250-1
Peng, S., Hummerjohann, J., Stephan, R., & Hammer, P. (2013). Short communication: Heat resistance of Escherichia coli strains in raw milk at different subpasteurization conditions. Journal of Dairy Science, 96(6), 3543–3546. https://doi.org/10.3168/jds.2012-6174
Ribeiro-Júnior, J. C., Tamanini, R., Alfieri, A. A., & Beloti, V. (2020). Effect of milk bactofugation on the counts and diversity of thermoduric bacteria. Journal of Dairy Science, 103(10), 8782–8790. https://doi.org/10.3168/jds.2020-18591
Sarkar, S. (2015). Microbiological considerations: Pasteurized milk. International Journal of Dairy Science, 10(5), 206–218. https://doi.org/10.3923/ijds.2015.206.218
Solano-Cornejo, M. A. (2013). Modelamiento de la cinética de desinfección superficial de tomates (Lycopersicum esculentum) frescos usando soluciones de cloro Modeling surface disinfection kinetics of fresh tomato (Lycopersicum esculentum) using chlorine solutions Scientia Agropecuaria. Scienta Agropecuaria, 4, 27–35.
Soltani, M., Sardari, H., Soofiabadi, M., & Hosseinpour, S. (2022). Ultrasound assisted processing of milk: Advances and challenges. Journal of Food Process Engineering, July, 1–20. https://doi.org/10.1111/jfpe.14173
Wang, Y., Han, X., Chen, X., & Deng, Y. (2021). Potential harmful of extracellular proteases secreted by Pseudomonas fluorescens W3 on milk quality. Journal of Food Processing and Preservation, 45(3), 1–8. https://doi.org/10.1111/jfpp.15192
Wei, X., Lau, S. K., Chaves, B. D., Danao, M. G. C., Agarwal, S., & Subbiah, J. (2020). Effect of water activity on the thermal inactivation kinetics of Salmonella in milk powders. Journal of Dairy Science, 103(8), 6904–6917. https://doi.org/10.3168/jds.2020-18298
Yu, T., Zhang, X., Feng, R., Wang, C., Wang, X., & Wang, Y. (2022). Comparison of the Effects of High Hydrostatic Pressure and Pasteurization on Quality of Milk during Storage. Foods, 11(18), 1–19. https://doi.org/10.3390/foods11182837
![]()

